 Сахарный диабет 1 и 2 типа представляет собой т.н. «болезнь цивилизации», напрямую связанную с современным образом жизни. Диагностика заболевания основывается на уровне глюкозы в крови (его повышении – гипергликемии). Кроме того, диагностика должна учитывать характерную клиническую картину болезни, таким образом, диагноз устанавливается на основе сочетания нескольких факторов, определяющих наличие недуга и его типа – 1 или 2.
Сахарный диабет 1 и 2 типа представляет собой т.н. «болезнь цивилизации», напрямую связанную с современным образом жизни. Диагностика заболевания основывается на уровне глюкозы в крови (его повышении – гипергликемии). Кроме того, диагностика должна учитывать характерную клиническую картину болезни, таким образом, диагноз устанавливается на основе сочетания нескольких факторов, определяющих наличие недуга и его типа – 1 или 2.
Для получения полного представления о сахарном диабете 1 и 2 типа необходимо знать, какова этиология и патогенез сахарного диабета.
- Этиология диабета является учением, объясняющим причинах возникновения болезни.
- Патогенез сахарного диабета является учением, объясняющим механизмы развития и курса болезни.
Патогенез и этиология сахарного диабета. Основные причины
 Сахарный диабет представляет собой метаболическое заболевание, вызываемое абсолютным или относительным недостатком инсулина. Поражённый организм не в состоянии справляться с глюкозой аналогично, как при физиологических условиях, что приводит к гипергликемии.
Сахарный диабет представляет собой метаболическое заболевание, вызываемое абсолютным или относительным недостатком инсулина. Поражённый организм не в состоянии справляться с глюкозой аналогично, как при физиологических условиях, что приводит к гипергликемии.
Сахарный диабет этиология которого является достаточно многообразной, представлена причинами, участвующими в различных механизмах, приводящих к заболеванию, которое, следовательно, является относительно разнообразной группой, а не клинической единицей. Для того, чтобы понять суть болезни, необходимо изучить основные данные о секреции и действии инсулина; этим и определяется сахарный диабет патогенез которого представлен именно механизмом действия этого гормона.
Гормон полипептид синтезируется в В-клетках панкреатических островков Лангерганса, который после отщепления сигнального пептида хранится в секреторных гранулах, как проинсулин.
Здесь доходит к расщеплению молекулы, таким образом, В-клетки высвобождают молекулы инсулина и, в то же, время эквимолярное количество С-пептида. С потоком крови оба пептида достигают печени, действующей в качестве фильтра, в котором уже во время первого прохода собирается около половины молекулы инсулина.
В такой способ организм защищает себя от чрезмерной активности инсулина, который в остром избытке может вызвать нежелательную гипогликемию. После прохождения через печень инсулин через большую циркуляцию крови попадает к периферическим тканям, в том числе, к жировой и мышечной ткани.
Кроме клеток печени и жировых клеток существует и поперечно-полосатые мышцы, которые имеют на своей клеточной мембране специфические рецепторы для инсулина. Молекулы инсулина связываются с альфа-субъединицами рецепторов и, следовательно, вызывают цепную реакцию, которая и обусловливает эффект гормона.
Вследствие связывания инсулина с рецептором активируется бета-субъединица, которая в своей внутриклеточной части (то есть, домене) вызывает активацию субстрата инсулинового рецептора. В настоящее время существует несколько типов этих молекул (IRS-1, IRS-6…), функции которых уже в значительной степени выяснены.
Субстраты IRS-1 и IRS-2 являются ключевой молекулой для каскадного управления другими реакциями, протекающими внутри клетки. Можно сказать, что существует два основных пути: в одном активируется фосфатидилинозитол-3-киназы (PI 3-К), во втором митогеном активируется протеинкиназа.
В результате доходит к транспортировке глюкозы в клетку, в которой участвуют инсулинозависимые переносчики глюкозы, кроме того, применяются метаболические эффекты инсулина, способствующие синтезу белков, липидов и гликогена, а также его активность к росту.
Конечный эффект зависит от совершенной гармонии отдельных частичных реакций, которые способствуют тому, что уровень глюкозы в крови и метаболические процессы поддерживаются в пределах физиологической нормы. Изменения, связанные с какой-либо частью цепи синтеза инсулина его целевым эффектом, приводят к дефектам толерантности к глюкозе, чей генезис, таким образом, значительно многообразен.
Речь идёт не об одном расстройстве, и диабет не является одним заболеванием, а группой заболеваний, для характеристики которых более подходит определение «синдром». Современная классификация диабета использует знания о патогенезе, которые позволяют рационально подходить к мерам лечения.
В определении диабета используется термин «абсолютный» или «относительный» дефицит инсулина, что выражается в патогенетическом подходе для оценки диабетического синдрома и его лечения. Он также является фундаментальной особенностью двух основных типов диабета, диабета 1 типа и 2 типа.
Сахарный диабет 1 типа
 Эндокринная часть поджелудочной железы при этом типе заболевания не в состоянии производить инсулин, что приводит к абсолютной недостаточности и склонности к кетоацидозу, поскольку, как высвобожденные жирные кислоты, так и аминокислоты являются кетопластическим субстратом для образования кетоновых тел.
Эндокринная часть поджелудочной железы при этом типе заболевания не в состоянии производить инсулин, что приводит к абсолютной недостаточности и склонности к кетоацидозу, поскольку, как высвобожденные жирные кислоты, так и аминокислоты являются кетопластическим субстратом для образования кетоновых тел.
Диабет вызывается аутоиммунным условным постепенным исчезновением B-клеток, что может быть продемонстрировано наличием аутоантител. Обнаружение антител против декарбоксилазы глутаминовой кислоты и тирозина фосфатазы (IA-2ab), но и инсулина, является доказательством того, что некоторые молекулы становятся аутоантигенными, против них направляется аутоиммунный ответ.
Антитела могут быть обнаружены перед проявлением диабета, то есть, до того, как у человека определяется отказоустойчивость глюкозы. Для развития аутоиммунного процесса необходимо наличие генетической предрасположенности, обусловленные изменениями в гаплотипам во II классе HLA системы.
Речь идёт об аллелях генов DR3, DR4 и DQA1 и DQB1, чьи ассоциации с сахарным диабетом 1 типа были неоднократно продемонстрированы. Некоторые аллели этих генов увеличивают риск развития заболевания (например, DQA1-0301, DQB1-0302, DQA1-0501 и т.д.), другие действуют, наоборот, защитно (DQA1-0102, DQB1-0602 и др.).
В особенности, при сочетании рисковых аллелей, увеличивается вероятность развития диабета 1 типа. Высокий риск был зарегистрирован у гетерозиготного генотипа DR3/DR4 или DQA1-0501 – DQB1-0201 – DQA1-0301 – DQB1-0,302.
Постепенно были охарактеризованы различные области и гены, ассоциированные с сахарным диабетом 1 типа (обозначенные, как маркеры IDDM от 1 до 15), из которых наиболее важным является маркер IDDM-1, связанный с хромосомой 6, который касается выше упомянутых генов HLA системы II класса, и IDDM-2, у которого присутствует связь с геном инсулина на хромосоме 11 (то есть, VNTR-полиморфизма).
Генетическая предрасположенность позволяет иммунной системе, включающей, как клеточный, так и гуморальный ответ, направлять действие против собственных антигенов. На молекулярном уровне этот процесс опосредован молекулами системы HLA, которые связывают соответствующий пептид, тем самым, способствуя его представлению и распознаванию рецепторов Т-лимфоцитов.
Для связывания пептида с геном HLA имеет важное значение присутствие аминокислоты серина или аланина на 57 положении бета-цепи молекул DQ2 или DQ8. Прочность пептидной связи усиливается аргинином, локализованным в положении 79 альфа-цепи молекул DQ.
Если DQ молекулы в положении 57 бета-цепи имеет аспарагиновую кислоту, к пептидной связи может не дойти, таким образом, предотвращена и его презентация Т-клеткам. Поэтому очевидно, что простая точечная мутация, приводящая к представлению различных аминокислот на конкретном связывающем участке HLA промежуточных молекул, может повлиять на развитие аутоиммунного действия.
Спусковым механизмом считаются экзогенные факторы, особенно, вирусная инфекция, как правило, обусловленная энтеровирусами. Чаще всего, была продемонстрирована связь с цитомегаловирусом, парамиксовирусом, вирусами Коксаки или краснухи. К тому же, также хорошо известно негативное влияние коровьего молока у детей раннего возраста или роль воздействия некоторых токсинов, но в деталях это действие остаётся неясным, во многих отношениях.
Разрушение островков сопровождается лимфоцитарной инфильтрацией, которая появляется в самом начале, ещё до начала процесса вымирания B-клеток. Решающую роль в этом процессе играют Т-лимфоциты. Для того, чтобы развился диабет, необходимо уничтожение около 90% В-клеток; этот процесс, как правило, продолжается в течение нескольких месяцев или, возможно, даже лет.
Точное время продолжительности этого процесса может быть трудно определимым, так как, встреча врача с пациентом происходит уже после проявления диабета. Тот факт, что аутоиммунный процесс может занимать по-разному длительное время, подкрепляют знания, полученные из исследований диабета LADA.
Тест: на определение риска сахарного диабета 2 типа
Присоединяйтесь к нашей группе Telegram и узнавай о новых тестах первым! Перейти в Telegram
Поделиться в Facebook Поделиться в VKРечь идёт о медленно развивающемся диабете, обусловленным аутоиммунным процессом у взрослых (то есть, латентном аутоиммунном диабете у взрослых), при котором демонстрируются антитела GADA или IA-2ab.
Первоначально заболевание имеет настолько мягкий ход, что взрослые люди, больные диабетом, часто лечатся пероральными антидиабетическими препаратами, либо же болезнь рассматривается, как сахарный диабет 2 типа. После переменного периода, который длится часто несколько лет, это лечение не показывает эффективности (поэтому, такое состояние идентифицируется, как вторичный отказ пероральных противодиабетических средств), вследствие чего назначается инсулиновая терапия.
Эта фаза соответствует времени, когда собственное производство инсулина является уже критическим, и организму нужен запас экзогенного инсулина. Тестирование на антитела уже на ранних стадиях показывает, что речь идёт не о диабете 2 типа, но о медленно прогрессирующем диабете 1 типа.
Таким образом, аутоиммунный процесс может у предрасположенных лиц проходить в любое время в течение жизни и на разных скоростях. Поэтому диабет 1 типа, приводящий к абсолютной зависимости от экзогенного поступления инсулина, может возникать во всех возрастных группах, включая зрелый возраст и, следовательно, сегодня полностью исключается ранее использованный термин «юношеский диабет».
Курс аутоиммунного процесса часто является более быстрым в молодом возрасте, но и в зрелом возрасте можно встретиться с характерным быстрым началом диабета 1 типа с кетоацидозом. Скорость процесса в значительной степени зависит от присутствия комбинации аллелей риска, т.е. генетической предрасположенности.
Помимо упомянутых групп пациентов с сахарным диабетом 1 типа с присутствием антител, следует упомянуть о диабетиках, у которых антитела не были обнаружены. Эти больные относятся к группе идиопатического сахарного диабета 1 типа, который в настоящее время считается его вторым подмножеством. Подробная информация о развитии заболевания в этой подгруппе диабета ещё не приведена.
Сахарный диабет 2 типа
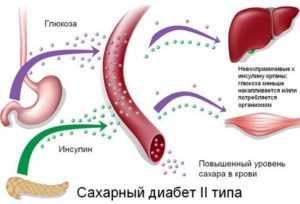 В отличие от предыдущей группы, сахарный диабет 2 типа имеет совершенно иной патогенез и одновременно характеризуется относительной недостаточностью инсулина. Синтез инсулина сохраняется, но высвобождение гормона из В-клеток на секреторный стимул глюкозой является не нормальным.
В отличие от предыдущей группы, сахарный диабет 2 типа имеет совершенно иной патогенез и одновременно характеризуется относительной недостаточностью инсулина. Синтез инсулина сохраняется, но высвобождение гормона из В-клеток на секреторный стимул глюкозой является не нормальным.
Расстройство влияет на первую, быструю фазу секреции гормона, производство которого уменьшается, и постепенно исчезает. Это меняет ход постпрандиальной гликемии, потому что задержанная секреция инсулина не удерживает её в пределах физиологической нормы.
Кроме нарушений секреции, которое также характеризуется другими отклонениями, дополнительно присутствуют нарушения в действии инсулина на ткани-мишени (печень, жировая и мышечная ткань).
Как правило, речь идёт о пострецепторных уровнях. В отношении определённых условий, связанных с нарушением связывания инсулина с рецепторами, которое, тем не менее, принадлежит к другой группе диабета, связывание инсулина при диабете 2 типа остаётся непораженным.
Поэтому, большое внимание посвящено пострецепторным каскадным реакциям, при этом ищутся т.н. кандидатные гены, которые могли бы объяснить наличие пониженной чувствительности к инсулину или резистентность к этому гормону.
Одновременная комбинация нарушений в секреции инсулина и снижения его влияния в тканях организма лежит в основе патогенеза сахарного диабета 2 типа. На обоих уровнях нарушение может количественно оцениваться по-разному, что обусловливает значительную разнородность проявлений. Заболевание развивается у генетически предрасположенных лиц, генетическая обусловленность, однако, совершенно отличается от диабета 1 типа.
Следует отметить, что резистентность к инсулину существует и без диабета, например, у страдающих ожирением людей с нормальной толерантностью к глюкозе. Жировая ткань является «барьером», препятствующим действию инсулина, но, скорее всего, не единственной причиной, так как сопротивление выражается также в мышцах и печени.
Указывается также участие гормонов жировой ткани (например, резистина, адипонектина) и других посредников, чьи регулирующие механизмы стали известны лишь в последние годы, а другие пока неизвестны. Инсулинорезистентность повышает секреторные требования, предъявляемые к B-клеткам, вследствие чего образуется гиперинсулинемии.
Хронически повышенный уровень инсулина, сам по себе, ограничивает эффект гормона, что, в свою очередь, ухудшает его производительность. Если человек не имеет генетической предрасположенности к нарушению секреции инсулина, стимулированная секреция гормона сохраняет толерантность к глюкозе в пределах нормы и, несмотря на присутствующую значительную индивидуальную резистентность к инсулину, он не заболеет диабетом.
Поэтому понятно, что для проявления диабета всегда должно существовать нарушение секреции инсулина, в то время, как резистентность к гормону может быть по-разному оценена и увеличивать степень расстройства.
За последние несколько лет исследования на животных показали, что между нарушением секреции инсулина и ухудшением его эффект существует внутренняя связь. Происходит ли эта связь также в организме человека, ещё предстоит выяснить.
В-клетки диабетика 2 типа вырабатывает инсулин, однако эта секреция не является достаточной, как у здорового человека, для поддержания уровня глюкозы в нормальном диапазоне, поэтому, в этом случае говорится об относительной нехватке инсулина. Даже небольшое количество этого гормона способно предотвратить развитие кетоацидоза, следовательно, диабета 2 типа в своей природе не имеет склонности к кетоацидозу.
Однако, изменяется метаболизм жиров, повышается уровень свободных жирных кислот, которые, сами по себе, способствуют развитию резистентности к инсулину. Их повышенное содержание было также продемонстрировано в мышцах. Нарушение в жировом обмене является настолько значительным, что для обозначения этого типа диабета используется термин «diabetes mell-lipidus».
По мнению некоторых экспертов, нарушение липидного обмена является первичным, в то время, как сбой в гомеостазе глюкозы происходит вторично, поэтому был введён термин «diabetes lipidus». Также цикл Рэндла (соотношение окисления жира и глюкозы) до сих пор обсуждается в связи с патогенезом резистентности к инсулину, хотя, скорее всего, у человек он не действует аналогично, как у экспериментальных животных.
Несомненным, однако, является тот факт, что метаболические пути глюкозы и жиров очень близки. В последнее время было показано, что свободные жирные кислоты входят в мышечные клетки, в которых, во-первых, активизируют выработку активных форм кислорода, во-вторых, путём активации протеинкиназы С приводят к аномальному фосфорилированию субстрата инсулинового рецептора, в ходе которого фосфорилирование серина и треонина блокирует нормальное фосфорилирование тирозина.
Это приводит к ингибированию сигнального каскада, включая уменьшение транспортировки глюкозы в клетки. С этой точки зрения при диабете 2 типа нарушение обмена вещества следует рассматривать гораздо глубже, чем простую аномалию в регуляции уровня глюкозы. Длительное воздействие на В-клетки повышенной концентрация липидов вызывает токсический эффект (то есть, липотоксичность), проявляющийся пониженной секрецией инсулина.
Точно так же, хронически повышенный уровень глюкозы вызывает ухудшенную реакцию В-клеток (глюкотоксический эффект глюкозы). Оба эффекта впоследствии комбинируются и влияют на периферическую ткань-мишень, где ухудшают действие инсулина и, таким образом, снижают утилизацию глюкозы. Диаграмма одновременно демонстрирует первичную липотоксичность в развитии гипергликемии.
С точки зрения динамики процесса следует отметить, что диабет типа 2 является прогрессирующим заболеванием, которое приводит к постепенному углублению (ускорению) нарушения секреции инсулина и его действия, с последующими метаболическими и органными нарушениями.
